Akkermansia muciniphila
Im Darm leben viele nützliche Bakterien, die besonders auch durch ihr Zusammenwirken positive Effekte für die menschliche Gesundheit entfalten. Ein Beispiel ist Akkermansia muciniphila: Das Bakterium bildet mit dem Butyrat-Produzenten Faecalibacterium prausnitzii ein wichtiges Gespann für die Versorgung der Darmschleimhaut.
Zu geringe Zellzahlen von Akkermansia muciniphila im Darm stehen mit verschiedenen Krankheiten wie Adipositas, chronisch-entzündliche Darmerkrankungen und Typ-2-Diabetes im Zusammenhang.
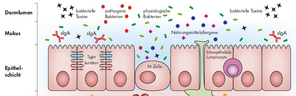
Ein wichtiger Faktor für unsere Gesundheit ist eine funktionierende Darmbarriere, die aus einem selektiv durchlässigen einreihigen Epithel, der aufgelagerten Schleimschicht und ansässigen Darmbakterien besteht. Den Schleim (= Mukus) produzieren spezialisierte Zellen, die Becherzellen. Sie liegen zwischen den normalen Darmschleimhautzellen (= Saumzellen oder Enterozyten).
Alles, was sich im Darmlumen befindet, zählt noch als außerhalb des Körpers. Erst, wenn es durch die Darmschleimhaut hindurchgelangt, tritt es ins Körperinnere ein.
So schützt die Darmbarriere vor schädlichen Einflüssen: beispielsweise vor Bakterien und deren Bestandteilen, vor Allergenen aus der Nahrung und vor Giftstoffen. Außerdem schützt der Mukus auch vor mechanischer Belastung und sorgt für ein gutes Gleiten des Nahrungsbreis beziehungsweise des Stuhls.

Fakt 1: Akkermansia muciniphila regt die Schleimproduktion an
Akkermansia muciniphilaist ein anaerob (= ohne Sauerstoff) lebendes Bakterium aus dem Stamm der Verrucomicrobiota, das im Jahr 2004 aus Fäkalien eines gesunden Menschen isoliert und beschrieben wurde (Derrien et al. 2004). Bis zu 4 Prozent der Bakterienpopulation im Dickdarm sind A. muciniphila (Derrien et al. 2008). Seine Besonderheit: Es ernährt sich vom Schleim, der dem Darmepithel aufliegt.
„muciniphila“ bedeutet "Schleim-liebend"
Da der Schleim wichtig ist, sahen Wissenschaftler die Bakterien, die sich vom Schleim ernähren, zuerst einmal als negativ wirkend an. Allerdings regt Akkermansia muciniphiladurch seine Schleim-abbauende Tätigkeit die Becherzellen an, immer wieder neuen Schleim zu produzieren. Die regelmäßige Erneuerung sorgt für eine vitale Schleimschicht.
Normalerweise stabilisiert A. muciniphila die Mukusschicht, wie tierexperimentelle Studien zeigen (Everard et al. 2013): In Mäusen, die mit einer stark fetthaltigen Diät ernährt wurden, war die Mukusschicht gegenüber normalen Mäusen deutlich reduziert. Die Gabe von A. muciniphila konnte das rückgängig machen. Andere tierexperimentelle Studien zeigen sogar eine Verdreifachung der Mukusdicke (van der Lugt et al. 2019).
In der Studie mit alternden Mäusen konnte die Gabe von A. muciniphila die altersbedingte Abnahme der Schleimschicht-Dicke im Dickdarm verhindern. Außerdem schwächte A. muciniphila mit dem Alter verbundene Entzündungen und immunologische Prozesse ab (van der Lugt et al. 2019).
Fakt 2: Akkermansia muciniphila und F. prausnitzii - ein starkes Duo für die Darmschleimhaut
Schleimhaut-ernährende Darmflora = mukonutritive Darmmikrobiota
Wie mittlerweile bekannt ist, helfen Darmbakterien die Darmschleimhaut gesund zu erhalten. Zwei gewichtige Vertreter sind unser Bakterium Akkermansia muciniphila und der Butyrat-Produzent Faecalibacterium prausnitzii. Beide stehen in einer engen Wechselbeziehung, wie die Abbildung zum Nährstoff-Kreislauf zwischen A. muciniphila und Faecalibacterium prausnitzii (MVZ Institut für Mikroökologie: IFM) zeigt:
Muzine sind die strukturgebenden Bestandteile des Schleims. Durch ihre hohe Kapazität, Wasser zu binden, quellen sie auf und vermitteln die Konsistenz des Mukus.
Akkermansia muciniphila ernährt sich vom Schleim, der den Epithelzellen des Darms aufgelagert ist (Everard et al. 2013). So regt es zum einen die Darmschleimhaut an, ständig neuen Schleim zu produzieren, und hält die Darmbarriere intakt. Zum anderen liefert es mit seinen Abbauprodukten (Oligosaccharide, Essigsäure, Propionsäure)(Geerlings et al. 2018) Nährstoffe für Faecalibacterium prausnitzii, das seinerseits Buttersäure produziert und damit die Zellen der Darmschleimhaut ernährt und sie so gesund erhält.
Während der Schleim im Dünndarm einschichtig ist, besteht die Schleimschicht im Dickdarm aus einer dichten inneren und einer lockeren äußeren Schicht (Hansson 2012). Die innere Schicht ist – im Gegensatz zum Dünndarm-Mukus – am Epithel verankert und stellt eine physikalische Barriere dar. In der Regel ist sie weitesgehend frei von Bakterien (Johansson et al. 2011). Im äußeren Bereich können dagegen kommensale Bakterien siedeln wie beispielsweise A. muciniphila.
Als anaerob (= ohne Sauerstoff) lebendes Bakterium besiedelt A. muciniphila hauptsächlich den Dickdarm; kommt aber in geringen Zellzahlen auch im Dünndarm und Blinddarm (Genauer: in der Appendix = Wurmfortsatz) und sogar in der Muttermilch vor (Geerlings et al. 2018).
Hundertjährige weisen höhere Zellzahlen von Akkermansia auf als jüngere Menschen
Fakt 3: Akkermansia muciniphila als Biomarker für die Gesundheit
Zahlreiche Studien beschreiben einen umgekehrten Zusammenhang zwischen den Zellzahlen von Akkermansia und diversen Erkrankungen. Genauer: Eine verringerte Häufigkeit von Akkermansia muciniphila ist mit zahlreichen Krankheiten verbunden. Das konnte nicht nur im Mausmodell, sondern auch beim Menschen gezeigt werden (Cani et al. 2022). Dazu gehören
Adipositas (= Fettleibigkeit)
Diabetes
Fettleber
Entzündungen im Darm
Mangelhaftes Ansprechen auf Krebsimmuntherapien
In verschiedenen Studien an Mäusen hat sich eine Gabe von A. muciniphila als therapeutisch wirksam erwiesen und Fettleibigkeit, Typ-2-Diabetes mellitus, Fettleber, Darmentzündungen und verschiedene Krebsarten (Dickdarmkrebs, Reaktion auf Immuntherapien) verbessert (Cani et al. 2022).
Dabei konnten Wissenschaftler verschiedene Mechanismen identifizieren, die eine Verbindung zwischen A. muciniphila und spezifischen Stoffwechselprodukten (Metaboliten) oder Membranproteinen und Wirtszelltypen oder Rezeptoren herstellen. Beispielsweise trägt A. muciniphila zur Aufrechterhaltung einer gesunden Darmbarriere bei und begrenzt auch das Auftreten von Entzündungen, die zahlreiche Erkrankungen verursachen.
Aber auch beim Menschen fanden Studien Zusammenhänge mit der Gesundheit. So stand die Zellzahl von A. muciniphila im umgekehrten Zusammenhang mit dem Taille-Hüft-Verhältnis (Waist–hip ratio*) und dem Nüchternblutzucker (Dao et al. 2016). Das bedeutet: Personen mit einer hohen Konzentration von A. muciniphila waren in der Regel schlanker als Personen mit weniger A. muciniphila und sie hatten einen geringeren Nüchternblutzucker.
*Das Verhältnis zwischen Taillen- und Hüftumfang dient der Einschätzung des Risikos für Herz-Kreislauferkrankungen. Es sollte bei Männern kleiner als 1,0 und bei Frauen kleiner als 0,85 sein.
In einer Studie wiesen Hundertjährige höhere Zellzahlen von Akkermansia spp. auf; genauso besaßen sogenannte Semi-Supercentenarians (= Personen mit einem Alter von 105 Jahren oder mehr) eine höhere Konzentration von Akkermansia als jüngere Altersgruppen (Biagi et al. 2016). Das zeigt: A. muciniphila spielt eine Rolle für die immunologische und metabolische Gesundheit von Semi-Supercentenarians und ist somit ein Biomarker für gesundes Altern.

Fakt 4: Ballaststoffe fördern A. muciniphila und F. prausnitzii
Akkermansia muciniphila und Faecalibacterium prausnitzii lassen sich durch eine gesunde Ernährung gezielt fördern: durch den Verzehr von Ballaststoffen.
Ballaststoffe: Sie sind bevorzugt in pflanzlicher Kost wie Obst, Gemüse und Getreide enthalten. Dazu gehören vor allem Inulin, Oligofruktose und resistente Stärke (= Stärke, die menschliche Verdauungsenzyme nicht aufschließen können).
Inulin, Oligofruktose und resistente Stärke fördern gezielt das Wachstum von A. muciniphilaund darüber hinaus von Faecalibacterium prausnitzii,Ruminococcus- und Roseburia-Arten. Unter resistenter Stärke vermehren sich auch Bifidobakterien, die gemeinsam mit Laktobazillen die Tight Junctions – die schrankenartigen Verbindungen zwischen den Darmepithelzellen – schützen (Maier et al. 2017, Keenan et al. 2015).
Resistente Stärke findet sich zum Beispiel in nicht ganz reifen Bananen, in Tiefkühlerbsen und in gekochten und wieder abgekühlten Stärke-haltigen Lebensmitteln wie Kartoffeln und Nudeln.
Wissenschaftler empfehlen, etwa sechs Gramm resistente Stärke pro Mahlzeit – also etwa 18 Gramm am Tag – zu verzehren, um gesundheitsfördernde Effekte zu erzielen. Eine Studie an Amerikanern zeigte jedoch: Sie verzehren im Rahmen ihrer westlichen Ernährung mit etwa fünf Gramm resistente Stärke pro Tag deutlich weniger (Birt et al. 2013). Deshalb können ballaststoffhaltige Nahrungsergänzungsmittel helfen: Ein Beutel Symbio Intest® enthält zum Beispiel fünf Gramm resistente Stärke.

Polyphenole gut für Akkermansia muciniphila
Auch eine Ernährung, die reich an Polyphenolen – beispielsweise aus Cranberry-Extrakt (Anhe et al. 2017) oder Resveratrol – ist, fördert A. muciniphila. Ebenso der Verzehr von Fischöl mit ungesättigten Omega-3-Fettsäuren (Jian et al. 2023).
Polyphenole: Sie gehören zu den sekundären Pflanzenstoffen und befinden sich besonders in den Randschichten von Gemüse, Getreide und Obst. Sehr bekannt ist Resveratrol aus roten Trauben(schalen).
Dagegen haben eine fettreiche Diät oder Alkoholkonsum negative Wirkungen auf die Menge an A. muciniphila (Jian et al. 2023).
Eine Ballaststoff-Lücke in der Ernährung führt zur Entwicklung einer mucolytischen (= Schleim-abbauenden) Mikrobiota
Fakt 5: Ohne Ballaststoffe kann A. muciniphila schädlich wirken
Das Angebot an Ballaststoffen entscheidet über das Ausmaß, mit dem A. muciniphila die Schleimschicht im Darm abbaut. Denn eine ballaststofffreie Ernährung bewirkt ein Umschalten im Stoffwechsel von A. muciniphila: Dann baut das eigentlich nützliche Bakterium den Schleim so stark ab, das es Löcher in die Schutzschicht frisst. Darunter leidet die Integrität der Darmbarriere (Desai et al. 2016).
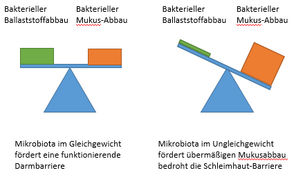
Unter einer ballaststoffarmen Ernährung gehen die Zellzahlen vieler ballaststoffabbauenden Bakterien stark zurück. Dadurch kann die Zellzahl von A. muciniphila unphysiologisch hoch ansteigen. Der damit verbundene übermäßige Schleimabbau löst Entzündungen des Epithels aus und (potenziell) krankmachende Bakterien können die Darmbarriere weiter angreifen (Desai et al. 2016, Parrish et al. 2023, Qu et al. 2023). Außerdem fördert das Ungleichgewicht das Entstehen von Nahrungsmittelallergien (Parrish et al. 2023).
Anhê FF et al. A polyphenol-rich cranberry extract reverses insulin resistance and hepatic steatosis independently of body weight loss. Mol Metab. 2017; 6(12): 1563–1573.
Biagi C et al. Gut Microbiota and Extreme Longevity. Curr Biol. 2016; 26 (11): 1480-5.
Birt DF et al. Resistant Starch: Promise for Improving Human Health. Adv Nutr. 2013; 4(6): 587–601.
Cani PD et al. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms. Nat Rev Gastroenterol Hepatol. 2022; 19 (10): 625-637.
Dao MC et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut. 2016; 65 (3): 426-36.
Derrien M et al. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int J Syst Evol Microbiol. 2004; 54 (Pt 5): 1469-1476.
Derrien M et al. The Mucin Degrader Akkermansia muciniphila Is an Abundant Resident of the Human Intestinal Tract. Appl Environ Microbiol. 2008; 74 (5): 1646-8.
Desai MS et al. A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell. 2016; 167 (5): 1339-1353.e21.
Everard A et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci U S A 2013; 110(22): 9066–9071.
Geerlings SY et al. Akkermansia muciniphila in the Human Gastrointestinal Tract: When, Where, and How? Microorganisms. 2018; 6(3): 75.
Hansson GC. Role of mucus layers in gut infection and inflammation. Curr Opin Microbiol. 2012 Feb; 15(1): 57–62.
Jian H et al. Akkermansia muciniphila as a Next-Generation Probiotic in Modulating Human Metabolic Homeostasis and Disease Progression: A Role Mediated by Gut–Liver–Brain Axes? Int J Mol Sci. 2023; 24(4): 3900.
Johansson MEV et al. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host–microbial interactions. Proc Natl Acad Sci U S A. 2011; 108(Suppl 1): 4659–4665.
Keenan MJ et al. Role of Resistant Starch in Improving Gut Health, Adiposity, and Insulin Resistance. Adv Nutr. 2015; 6(2): 198–205.
Maier TV etal. Impact of Dietary Resistant Starch on the Human Gut Microbiome, Metaproteome, and Metabolome. mBio. 2017; 8 (5): e01343-17.
MVZ Institut für Mikroökologie (IFM). KyberKompaktPRO: neue Diagnostik zu Mukusbildung und Schleimhautversorgung im Darm (Grafik). https://www.ifm-herborn.de/gesundheits-blog/kyberkompaktpro-neue-diagnostik-zu-mukusbildung-und-schleimhautversorgung-im-darm abgerufen am 27.11.2023.
Parrish A et al. Akkermansia muciniphila exacerbates food allergy in fibre-deprived mice. Nat Microbiol. 2023; 8(10): 1863–1879.
Qu S et al. Excessive consumption of mucin by over-colonized Akkermansia muciniphila promotes intestinal barrier damage during malignant intestinal environment. Front Microbiol. 2023; 14: 1111911.
van der Lugt B et al. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1−/Δ7 mice. Immun Ageing. 2019: 16: 6.